PREPARACIÓN Y ESTERILIZACIÓN DE MATERIALES Y MEDIOS DE
CULTIVO
Esta práctica se
llevó a cabo el día lunes y jueves 12 y 15 de marzo 2012, en las instalaciones
del laboratorio para prácticas de análisis clínicos del CBTis 199, como parte
del programa de 4º semestre para la preparación de la carrera de Laboratorista
Clínico, en su subdivisión procesar cultivos bacteriológicos.
OBJETIVO
Conocer los
principios generales de las técnicas de esterilización de materiales de vidrio y medios de cultivo de
uso común en Microbiología, así como de observar el efecto y la importancia de
las condiciones asépticas en el control de la contaminación microbiana.
FUNDAMENTO
Los microorganismos, como todos
los otros seres vivos, son verdaderamente susceptibles a los cambios de las
condiciones ambientales y en la medida
en que se han podido adaptar a estos cambios, se han distribuido en una gran
diversidad de hábitats incluyendo los de condiciones extremas de tipo físico y químico.
La esterilización se define como la destrucción
completa de todos los microorganismos presentes incluyendo las formas
vegetativas y las esporas.
Para lograr la destrucción de las bacterias,
existen diferentes medios como son: la acción de los agentes químicos y los
antibióticos.
Los principales métodos de esterilización
empleados en un laboratorio de bacteriología son:
Calor húmedo, seco y filtración para los líquidos,
sin olvidar que cuando se requiere una esterilización más completa se efectúa
está usando gas (óxido de etileno) y el área de trabajo se expone a los rayos
ultravioleta.
Entre los principales métodos físicos se
encuentra la acción del calor, el cual puede ser seco o húmedo, considerando
que el punto térmico mortal se define como la temperatura necesaria para producir la muerte de la bacteria en un
tiempo determinado.
El calor húmedo se aplica para esterilizar
medios de cultivo, soluciones y cultivos bacterianos que se desechan, siendo el
más recomendable el autoclave.
MATERIAL
v Mechero de
Bunsen y Fisher
v Tripie
v Tela de
asbesto
v Portaobjetos
v Cuba de tinción
v Matraz Erlenmeyer
de 250 ml
v Algodón
v Gasa
v Papel estraza
v Cinta testigo
v Cajas Petri
v Olla exprés
v Asa de siembra
SUSTANCIAS:
Ø Muestra biológica:
heces fecales y orina
Ø Agar EMB
Ø Agar Salmonella-Shigella
Ø Fenol
Ø Agua destilada
Ø Colorantes de Gram
Ø Aceite de inmersión
PROCEDIMIENTO
1. Lavar perfectamente dos matraces con escobillón y detergente. Enjuagar con
abundante agua corriente
2. Dejar escurrir y secar sobre una toalla o papel de envoltura.
3. Pesar con ayuda de una balanza la cantidad necesaria de medio de cultivo
de agar EMB y S.S. para 40 ml de agua.
4. Elaborar con algodón y gasa unos tapones para los matraces, que ajuste
con holgura, sobre los que finalmente se colocara un capuchón de papel estraza.
5. Vaciar 40 ml de agua destilada en el matraz ya seco.
6. Limpiar el área de trabajo y rociarla con fenol para desinfectarla. Encender
el mechero de Bunsen, y colocar sobre este el tripie y encima la tela de
asbesto.
7. Verter el polvo del medio S.S. al matraz, colocar este último sobre la
tela de asbesto y disolver calentado. Dejarlo hervir NO MAS DE UN MINUTO
8. Cuando se alcance el punto de ebullición, bajar el matraz del fuego,
flamear el tapón y la boca del matraz, para taparlo y colocarle su capuchón de
papel. Repetir los pasos 5-8 para el
medio EMB.
9. Colocar las cajas de Petri cerca del mechero, y verter en una de ellas
el medio S.S. hasta la mitad. Esperar a que solidifique.
a) En la olla exprés verter agua hasta el nivel indicado (1/3 parte)
b) Colocar la base dentro de esta y ponerla al fuego (con los mecheros
Fisher)
d) Cerrar la olla y esperar a que la temperatura se eleve
e) Dejar que se caliente hasta los 121°C o 15 lbs de presión revisando continuamente
la escala del manómetro. Una vez alcanzada esta temperatura deberá bajarse el
nivel del fuego sacando y metiendo uno de los mecheros.
g) Apagar el fuego y dejar a que la presión descienda a 0.
h) Abrir cuidadosamente la olla y sacar los medios ya esterilizados.
11. Acercar el medio al área de trabajo, que se mantiene aséptica.
12. Dejar enfriar al medio, hasta una temperatura en la que el matraz
caliente pero no queme la piel, y verter suavemente en la caja o cajas Petri el
medio de cultivo.
13. Una vez que se tienen solidificados los medios de cultivo, se procede a
sembrar en ellos. Se toma el asa, se flamea y se toma un poco de la muestra de
heces, para hacer el rayado de la placa en sectores, sembrando en ambos medios.
Se flamea nuevamente el asa y se procede a la misma operación pero con la
orina.
1. Transcurrido este tiempo, sacar los medios de cultivo y hacer la descripción
morfológica de las colonias obtenidas en forma cualitativa
3. Limpiar
la mesa o lugar de trabajo con fenol
4. Prender
el mechero y esterilizar el asa en la flama del mechero hasta que se ponga al
rojo vivo.
5.
Dejar enfriar el asa para
evitar que al tomar la muestra los microorganismos sean destruidos.
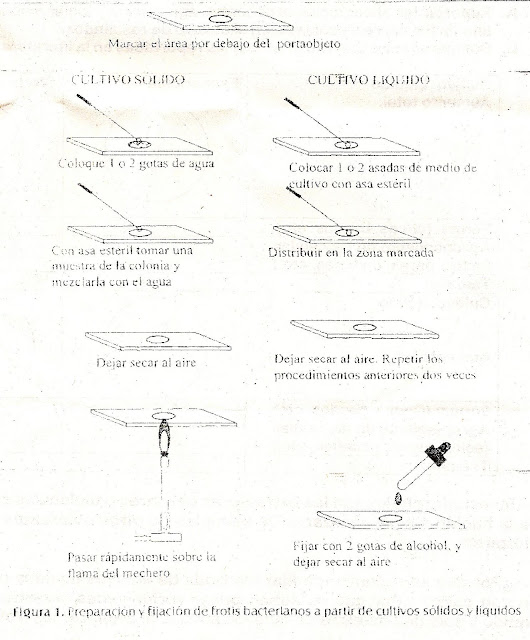
6.
Colocar la muestra en el centro
del portaobjetos, extender suavemente en una área circular de 2 cm de diametro
aproximadamente o colocar en el centro del portaobjetos una gota de agua
destilada en la que se mezcla una pequeña muestra del cultivo y esterilizar
nuevamente el asa. Dejar secar el frotis al aire
8.
Teñir por tinción de Gram
9.
Dejar secar al aire y observar
la preparación al microscopio localizando con el objetivo 10x, pasar luego a
40x y observar a detalle con el objetivo 100x, colocando previamente una gota
de aceite de inmersión.
RESULTADOS
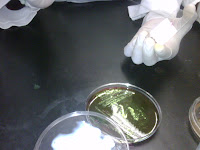
Al preparar y esterilizar los medios de cultivo se obtuvo
una solución homogénea libre de microorganismos, y al verterlas en las cajas y
solidificar, el medio S.S. era color rosado y el medio EMB, lucía verde y a
trasluz se veía rojizo.
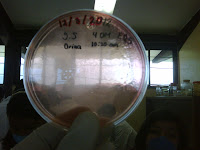
MEDIO SALMONELLA-SHIGELLA
Al sacar
los medios con crecimiento, se tuvieron los siguientes resultados:
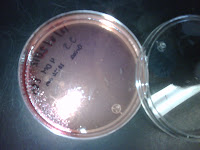
MEDIO EMB
 |
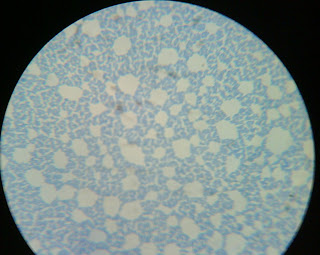
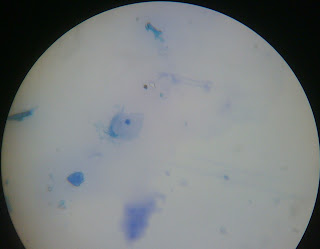
Frotis
medio S.S. 100x
Se distinguen con un poco de dificultad en este campo algunos bacilos
gramnegativos, algo cortos, probablemente se trate de Shigella dysenteriae
|
 |
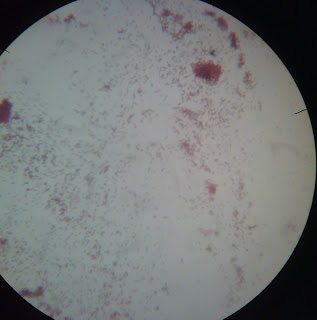
Frotis
medio EMB, 100x
Se distinguen perfectamente bacilos
gramnegativos, algunos agrupados en palizadas del frotis de la colonia verde metálico,
sin duda alguna se trata de Escherichia coli
|
CONCLUSIÓN
Al sacar el material de la
olla, el trozo de cinta testigo tiene una pequeñas bandas que al reaccionar con
calor, se tornan color negro o gris y es
debido a que cuando se expone a un proceso de esterilización por vapor, los
reactivos de la cinta cambian su color al reaccionar.
Uno de los sistemas más importantes para la
identificación de microorganismos es observar su crecimiento en sustancias
alimenticias artificiales preparadas en el laboratorio.
El material alimenticio en el que crecen los microorganismos se llama medio de cultivo y el crecimiento de los microorganismos es el cultivo.
Para que las bacterias crezcan adecuadamente en un medio
de cultivo artificial debe reunir una serie de condiciones como son:
§ Temperatura
§ Grado de
humedad
§ Presión
de oxígeno adecuado
§ Un grado
correcto de acidez o alcalinidad
§ Contener
los nutrientes y factores de crecimiento necesarios
§ Debe
estar exento de todo microorganismo contaminante
Por eso, la base
de muchos medios de cultivo es una infusión de extractos de carne y Peptona a
la que se añadirán otros ingredientes, dependiendo de las necesidades y
exigencias de las bacterias.
Fuentes consultadas:
·
Métodos de esterilización, consultado el día 17 de marzo del
2012, en http://www.monografias.com/trabajos10/meste/meste.shtml
·
Medios de
cultivo en Microbiología, consultado el día 17 de marzo 2012 en http://www.microinmuno.qb.fcen.uba.ar/SeminarioMedios.htm